قاعده های فاجانس (Fajans rules ) : قاعده هایی که در باره قطبیت پذیری آنیون ها و قدرت قطبی کنندگی کاتیون ها ، تاثیر آن در کاهش خصلت یونی پیوند ، پیدایش و افزایش خصلت کووالانسی در ترکیب های یونی توسط فاجانس وضع شد .
قاعده اول فاجانس : هرچه پتانسیل یونی کاتیون ( یعنی نسبت بار الکتریکی کاتیون به شعاع آن ) بیشتر باشد ، با قدرت بیشتری می تواند آنیون را قطبی کند . یعنی ابر الکترونی آن را که کروی در نظر گرفته می شود ، تغییر شکل داده و به سمت خود می کشد و با آن همپوشانی کند .
بر همین اساس است که مثلا بریلیم ، عمدتا ترکیب هایی کووالانسی با خصلت کووالانسی بالا ، اما پتاسیم ترکیب های یونی تشکیل می دهد . زیرا شعاع کاتیون بریلیم بسیار کوچک و در نتیجه پتانسیل یونی آن زیاد ، اما شعاع کاتیون پتاسیم
نسبتا زیاد و پتانسیل یونی آن بسیار کوچک است .
در شکل های زیر، نمایش قطبی شدن آنیون به وسیله کاتیون را مشاهده می کنید .
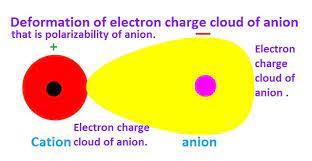
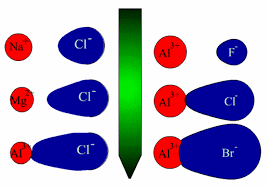
قاعده دوم فاجانس : هرچه آنیون نرم تر یعنی بار الکتریکی منفی آن بیشتر و یا شعاع آن بزرگتر باشد بهتر به وسیله کاتیون قطبی می شود . بر اساس این قاعده است که می توان دریافت که چرا آلومینیم قلوئورید عمدتا یونی است ، اما آلومینیم برمید
خصلت کووالانسی دارد . زیرا یون فلوئورید
، آنیونی کوچک ( سخت ) است و یون آلومینم
نمی تواند ابر الکترونی آن را تغییر شکل دهد . اما یون برمید
آنیونی نسبتا حجیم ( نرم ) است و یون آلومینیم به آسانی می تواند آن را تغییر شکل داده و با آن همپوشانی بیشتری داشته باشد .
قاعده سوم فاجانس : بر اساس قاعده سوم فاجانس ، هرچه بارموثر هسته کاتیون بیشتر باشد ، چون جاذبه هسته را بر لایه ظرفیت آن افزایش می دهد ، سبب می شود که کاتیون بتواند آنیون را بیشتر قطبی کند و خصلت کووالانسی پیوند را افزایش دهد .
می توانیم برای نمونه کاتیون های کلسیم و جیوه (II)
را در نظر بگیریم . پتانسیل یونی این کاتیون ها با هم برابر است . از این رو انتظار داریم که ترکیب کلرید آن ها خصلت یونی یا کووالانسی برابر داشته باشند اما تجربه نشان می دهد که خصلت کووالانسی جیوه(II)کلرید بسیار زیاد است به طوری که جامد آن در دمای بالا ، عمدتا ماهیت مولکولی پیدا می کند و در دمای 276 درجه سلسیوس ذوب می شود در حالی که کلسیم کلرید در دمای 772 درجه سلسیوس ذوب می شود .
ما می توانیم این رویداد را بر اساس قاعده سوم فاجانس توجیه کنیم زیرا می دانیم که کلسیم فلزی از گروه قلیایی خاکی در صورتی که جیوه فلز واسطه سنگین است و مقدار بار موثر کاتیون به مراتب بیشتر از مقدار بارموثر است ( فاجانس ) در نتیجه بهتر می تواند ابر الکترونی آنیون ها را بیشتر قطبی کند و در نهایت خصلت کووالانسی پیوند را افزایش دهد .
سوال :چرا نقره فلوئورید در آب حل می شود ، در حالی که سایر هالید های نقره در آب نامحلول هستند ؟
با افزایش حجم آنیون هالید بر نرمی و قابلیت قطبی شدن آن به وسیه کاتیون افزوده می شود و پیوند بین یون هالید و یون نقره خصلت کووالانسی بیشتری پیدا می کند ( فاجانس ) در نتیجه از میزان انحلال پذیری آن در آب ( حلال قطبی ) کاسته می شود .
تذکر : با افزایش یون هالید در هالید های نقره ، از میزان انحلال پذیری در آب کاسته می شود .
سوال : چرا دمای تجزیه لیتیم کربنات خیلی کمتر از دمای تجزیه کلسیم کربنات
است ؟ ( لیتیم کربنات در دمای 100 درجه و کلسیم کربنات در دمای 900 درجه سلسیوس تجزیه می شود . )
کاتیون لیتیم حجم کوچک تری نسبت به کاتیون کلسیم
دارد ، در نتیجه پتانسیل یونی بیشتر بوده و میزان قطبش پذیری یون کربنات را افزایش می دهد ( طبق قاعده فاجانس ) و بر اثر از دست دادن تقارن خود ، به آسانd به یون اکسید و مولکول کربن دی اکسید تجزیه شود تا یون لیتیم با یون اکسید حاصل ترکیب پایدارتر لیتیم اکسید را به وجود آورد .
سوال : برای یک کاتیون مشخص ، با افزایش اندازه آنیون ، خصلت کووالانسی پیوند چگونه تغییر می کند ؟ با توجه به قاعده فاجانس ، با بزرگ شدن حجم آنیون ، خصلت کووالانسی پیوند افزایش می یابد . خصلت کووالانسی
سوال : برای یک آنیون مشخص با کاهش حجم کاتیون ، حصلت کووالانسی پیوند چگونه تغییر می کند ؟ با بهره گیری از قاعده فاجانس ، با کاهش حجم کاتیون ، خصلت کووالانسی پیوند طبق قاعده فاجانس افزایش می یابد . خصلت کووالانسی
سوال : با افزایش بار الکتریکی هر یک از یون ها در ترکیب یونی ، خصلت کووالانسی پیوند چه تغییری می کند ؟ با افزایش بار یون ، خصلت کووالانسی پیوند افزایش می یابد . خصلت کووالانسی
سوال : در کاتیون های با آرایش الکترونی غیر از گاز نجیب ، خصلت کووالانسی پیوند چگونه است ؟ هرگاه کاتیون به آرایش گاز نجیب نرسیده باشد ، خصلت کووالانس یپیوند آن بیشتر خواهد بود . خصلت کووالانسی
سوال : با افزایش خصلت کووالانسی پیوند در یک ترکیب یونی ، میزان انحلال پذیری آن در آب چه تغییری می کند ؟ کاهش می یابد .




