هیبریداسیون اوربیتال ها و نقش آن در مقدار الکترونگاتیوی اتم ، بیانگر این است که اصولاً هیبریداسیون اوربیتال های یک اتم ضمن ترکیب شدن آن با اتم های دیگر موجب افزایش مقدار الکترونگاتیوی آن می شود . زیرا اوربیتال S لایه ظرفیت آن اتم در تشکیل اوربیتال های هیریدی همراه با اوربیتال های P و d شرکت می کند . چون سطح انرژی تراز S لایه ظرفیت از سطح انرژی ترازهای Pو d ( در عناصر اصلی ) پایین تر است ، اوربیتال های هیبریدی حاصل ، نسبت به اوربیتال های اتمی خالص P و یا d تحت تاثیر نیروی جاذبه بیشتری از طرف هستۀ اتم مقابل قرار می گیرد . در نتیجه اتم به جذب الکترون های پیوندی تمایل بیشتری پیدا می کند . به بیانی دیگر الکترونگاتیوی آن بیشتر می شود .
بر این اساس می توان پیش بینی کرد که هر چه سهم اوربیتال S در تشکیل اوربیتال های بیشتر باشد ( به بیان یدیگر ، هرچه اوربییتال های هیبریدی دارای خصلت S بیشتری باشند . ) الکترونگاتیوی اتم در پیوندی که با چنین اوربیتال هیبریدی تشکیل می شود ، بیشتر خواهد بود .
دانشمندانی همچون بنت(Bent) ، مولیکن ، یافه و هینس چگونگی و میزان تاثیر هیبرید شدن اوربیتال ها را بر الکترونگاتیوی اتم مورد بررسی قرار دادند .
جدول مقادیر الکترونگاتیوی اتم های کربن ، نیتروژن و اکسیژن در ارتباط با نوع هیبرید شدن
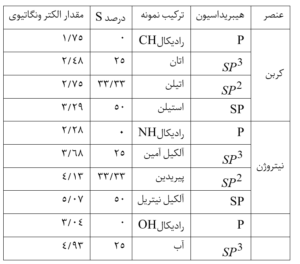
با توجه به داده این جدول ، الکترونگاتیوی 3 در مورد اتم نیتروژن را باید حالت حد واسطی بین اوربیتال خالصP و اوربیتال هیبریدی \( SP^{3} \)و الکترونگاتیوی 3.5 برای اتم اکسیژن را نیز باید به حالت حدواسطی بین اوربیتالP خالص و اوربیتال هیبریدی \( SP^{3} \)نسبت داد .
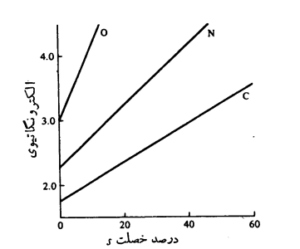
قابل توجّه است که بر اساس داده های جدول بالا ، میزان تاثیر هیبریداسیون اوربیتال ها در تغییر الکترونگاتیوی عناصر مختلف یکسان نیست . بلکه هرچه اتم کوچک تر و الکترونگاتیوی آن بیشتر باشد ، شدت این تاثیر بیشتر است . و حتّی می توان اضافه کنیم که هرچه برای عناصر نافلزی هم دوره ، عدد اتمی بیشتر باشد ، شیب تغییرات الکترونگاتیوی بیشتر خواهد بود .
با توجّه به این که میزان الکترونگاتیوی هیدروژن بیشتر از فسفر است ، باید انتظار داشت که در ترکیبی مانند\( PH_{3} \) ( فسفین ) اعداد فسفر و هیدروژن به ترتیب برابر 3+ و 1- باشد ، در صورتی که چنین نیست زیرا اگر چنین باشد ، مثلاً واکنش زیر نمی تواند از نوع اکسایش – کاهش باشد .\( P_{4}+3OH^{-}+3H_{2}O\longrightarrow 3H_{2}PO_{2}^{-}+PH_{3} \)
زیرا در آن صورت ، در هر دو ترکیب فسفردار حاصل از این واکنش ، عدد اکسایش فسفر برابر 3+ خواهد بود که در آن صورت فقط یک عنصر تماماً اکسید شده ( یعنی فسفر از عدد اکسایش صفر به 3+ رسیده است . ) و کاهش شونده ای در واکنش شرکت نداشته است . بدیهی است که چنین فرضی قابل قبول نیست ، زیرا حضور حداقل یک عنصر کاهش شونده ( عدد اکسایش آن کاهش یابد ) در مقابل عنصر اکسید شونده امری اجتناب ناپذیر است . پس باید قبول کرد که در مولکول فسفین عدد اکسایش فسفر برابر 3- است . با توجه به این که با بررسی های مولیکن و یافه و بر اساس تاثیر هیبریداسیون\( SP^{3} \) اوربیتال های اتم بر الکترونگاتیوی آن ، الکترونگاتیوی فسفر در حالت هیبریدی \( SP^{3} \)برابر 2.79 و با اوربیتال های اتمی خالصP برابر 1.84 گزارش شده است . با قبول این که اتم فسفر در مولکول فسفین با اوربیتال های هیبریدی \( SP^{3} \)و یا حدواسط بین اوربیتال های اتمی خالصP و هیبریدی \( SP^{3} \)با اتم های هیدروژن پیوند برقرار کرده است می توان عدد اکسایش 3- را برای فسفر در \( PH_{3} \)توجیه کرد .
تاثیر بار الکتریکی جزئی اتم \( (\delta\pm ) \)بر الکترونگاتیوی آن : هینس و یافه در سال 1962 و هیویی در سال 1965 با بررسی های دقیقی که انجام داده بودند ، دریافتند که الکترونگاتیوی عناصر نه تنها بر حسب هیبریداسیون اوربیتال های لایه ظرفیت آنها در یک ترکیب تغییر می کند ، بلکه از تغییرات بار جزئی اتم در آن ترکیب نیز پیروی می کند . به طوری که مجموع مقادیر انرژی های یونش \( (E_{I}) \)و الکترونخواهی اتم\( (E_{A}) \) ، نسبت به بار الکتریکی آن در آن ترکیب مطابق شکل زیر برای اتم های فلوئور و کلر همواره به صورت یک سهمی تغییر می کند . \( E=E_{I}+E_{A}=\beta\delta^{2}+\alpha \delta \)
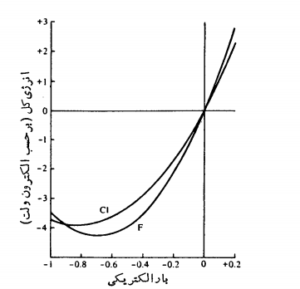
قابل توجه است که هینس و یافه با توجه به هیبریداسیون اوربیتال ها و بارجزئی اتم ، برای محاسبۀالکترونگاتیوی اوربیتال های هیبریدی معادلات زیر را به دست آوردند .
\( X(0)=\frac{1}{2}(3E_{I}+E_{(EA)})\\ X(1)=\frac{1}{2}(E_{I}+E_{(EA)})\\ X(2)=\frac{1}{2}(3E_{I}-E_{(EA)})\\ \)
\( X_{0} \)الکترونگاتیوی اوربیتال هیبریدی خالی یا یون \( A^{+} \)، \( X_{1} \)الکترونگاتیوی اوربیتال هیبریدی تک الکترونی یا اتم خنثی A و \( X_{2} \)الکترونگاتیوی اوربیتال هیبریدی دو الکترونی یا یون \( A^{-} \)است .
مثال:الکترونگاتیوی \( C , C^{+} \)و \( C^{-} \)را به روش هینس و یافه حساب کنید .
\( X_{(C^{+})}=\frac{1}{2}(3\times14.64-1.34)=21.29\\ X_{(C)}=\frac{1}{2}(14.64+1.34)=7.99\\ X_{(C^{-})}=\frac{1}{2}(3\times1.34-14.64)=-5.31\\ \)
تاثیر اتم های دیگر در الکترونگاتیوی اتم مرکزی ، الکترونگاتیوی گروه ها و رادیکال ها : بدیهی است که مقدار مشخصی از الکترونگاتیوی اتم را نمی توان به آن اتم در ترکیبات مختلف آن نسبت داد . مثلاً حتی با وجود اینکه هیبریداسیون اوربیتال های اتم کربن در ترکیباتی نظیر \( CHI_{3},CHBr_{3},CHCl_{3},CHF_{3}, CH_{4} \)و غیره از نوع است . اما الکترونگاتیوی کربن در پیوند C-H در آنها برابر نیست . زیرا در گروه های\( CI_{3},CBr_{3},CCl_{3},CF_{3}, CH_{3} \) پیوندهای X-C قطبی بوده و میزان قطبیت آنها در این گروهها یکسان نیست . در نتیجه مقدار بارالکتریکی که بر روی هر اتم کربن القا می کنند ، متفاوت است و الکترونگاتیوی کربن در آنها تفاوت داشته و به صورت زیر تغییر می کند .
\( CF_{3}>CCl_{3}>CBr_{3}>CI_{3} \)




برای نوشتن دیدگاه باید وارد بشوید.