فلزات قلیایی و یا فلزهای اصلی گروه اول (IA) عبارت اند از : لیتیم ، سدیم ، پتاسیم ، روبیدیم ، سزیم و فرانسیم که جزو الکتروپوزیتیوترین عنصرها و فعّال ترین ( واکنش پذیرترین ) عنصرهای فلزی هستند . ( الکتروپوزیتیو یعنی تمایل زیاد به از دست دادن الکترون و تشکیل کاتیون )
وجود در طبیعت : سدیم به طور عمده به صورت سدیم کلرید\( (NaCl) \) ، سدیم نیترات\( (NaNO_{3}) \) و سدیم سولفات\( (Na_{2}SO_{4}) \) ، پتاسیم به طور عمده به صورت کارنالیت\( (KCl,MgCl_{2}.6H_{2}O) \) ، شوره\( (KNO_{3}) \) ، پتاسیم کلرید\( (KCl) \) و پتاسیم سولفات\( (K_{2}SO_{4}) \) در طبیعت وجود دارند . لیتیم ، روبیدیم و سزیم به نسبت کم و به صورت سیلیکات در طبیعت یافت می شوند . فرانسیم به علت پرتوزا ( رادیو اکیتو ) بودن و ناپایداری زیاد ، در طبیعت وجود ندارد .
طرز تهیه : فلزات قلیایی را به طور معمول از برقکافت ( الکترولیز ) کلرید آنها در حالت مذاب تهیه می کنند . برای نمونه ، چگونگی تهیه سدیم به روش برقکافت سدیم کلرید مذاب در شکل زیر :
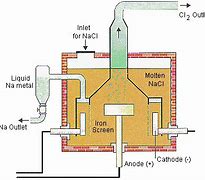
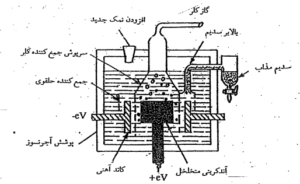
خواص گروهی
- فلزهای قلیایی همگی در لایه ظرفیت اتم خود ، تنها یک الکترون در تراز ( زیرلایه ) S دارند و به آسانی می توانند این الکترون را از دست بدهند و به کاتیون \( M^{+} \)یا آرایش الکترونی گاز نجیب قبل ازخود در آیند ، از این رو تنها با عدد اکسایش 1+ در ترکیب ها وجوددارند .
- انرژی نخستین یونش و پتانسیل کاهش الکترواستاندارد آنها در مقایسه با فلزهای دیگر کمترین است . از این رو فعالترین فلزها محسوب می شوند . در شرایط معمولی با آب و اکسیژن هوا ترکیب می شوند و د رگرما با بسیاری از نافلزها واکنش می دهند . \( 2Na+H_{2}O\longrightarrow 2NaOH+H_{2} \hspace{5cm}4Li+O_{2}\longrightarrow 2Li_{2}O \)
- تمام ترکیب های آنها یونی اند یا به طور عمده خصلت یونی دارند ( در حالت گازی ، مولکول دو اتمی با یک پیوند کووالانسی تشکیل می دهند . در ترکیب های آلی فلزی پیوند اتم آنها با اتم های الکترونگاتیو\( (C , N, O) \) تا حدی خصلت کووالانسی دارد . )
- تمام ترکیب های آنها در آب حل می شود . البته نمک های اسیدهای ضعیف یا لیتیم در آب کم حل می شود . تنها ترکیب نامحلول سدیم ، سدیم استات روی- اورانیل با فرمول: \( NaZn(UO_{2})_{3}(CH_{3}COO)_{9}.6H_{2}O \) است . آنیون های حجیم مانند\( [Co(NO_{2})_{6}]^{3-},PtCl_{6}^{2-},IO_{4}^{-},ClO_{4}^{-} \) و …… با کاتیون های حجیم این گروه مانند\( Cs^{+},Rb^{+},K^{+} \) و\( NH_{4}^{+} \) در آب به نسبت حل می شوند . در \( LiClO_{3}.3H_{2}O \)حتی در حالت حامد ، کاتیون به صورت آبپوش شده وجود دارد و برعکس پتاسیم کلرات به خوبی در آب حل می شود .
- همه فلزهای این گروه در سیستم مکعبی مرکز پر (B.C.C) متبلور می شوند . چون این سیستم تبلور ، نیم انباشته و فاصله میان اتم های فلز در آن زیاد است ، انرژی شبکه بلور آنها به نسبت کم است . از این رو ، سختی و دمای ذوب آنها پایین است .
- غیر از سزیم که جلای زرد طلایی دارد ، همگی جلای نقره ای دارند .
- فلزهای قلیایی همگی نرم اند . البته لیتیم به نسبت سخت ( اما نرمتر از سُرب ) است .
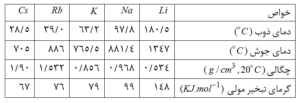
روند تغییر خواص عنصرهای این گروه (IA) :تغییر خواص عنصرهای این گروه نسبت به عدد اتمی ، روندی به نسبت منظم دارد که در مورد عنصرهای گروه های دیگر مشاهده نمی شود .برای مثال دمای ذوب ، انرژی نخستین یونش ، الکترونگاتیوی ، انرژی شبکه بلور و سختی آنها با افزایش عدد اتمی به طور منظّم کاهش می یابد . در مقابل ، شعاع های اتمی و یونی و واکنش پذیری آنها به طور منظّم افزایش می یابد .
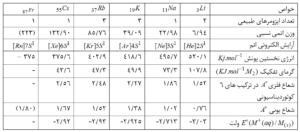
خواص شیمیایی : لیتیم با عنصرهای دیگر این گروه در برخی خواص تفاوت دارد . برای مثال ، فلزی به نسبت کم اثر است و با آب به آرامی واکنش می دهد . برخلاف عنصرهای دیگر این گروه با استیلن واکنش نمی دهد ، برخلاف آنها با نیتروژن در دمای 25 درجه سلسیوس واکنش می دهد و لیتیم نیترید\( Li_{3}N \) را به وجود می آورد . از این رو برای جذب نیتروژن به کار می رود . لیتیم از نظر پایداری و تجزیه گرمایی نیترات نیز با فلبزهای دیگر قلیایی تفاوت دارد . زیرا لیتیم نیترات ، بر اثر گرما به اُکسید ، اما نیترات فلزهای قلیایی به نیتریت تبدیل می شود . \( 4LiNO_{3}\overset{\Delta}\longrightarrow 2Li_{2}O+4NO_{2}+O_{2}\\ 2KNO_{3}\overset{\Delta}\longrightarrow2KNO_{2}+O_{2} \)
لیتیم در بسیاری از خواص ، مشابه منیزیم است . ( تشابه قطری ) سدیم به شدت ، پتاسیم با اشتعال و روبیدیم و سزیم با انفجار با آّ واکنش می دهند ، گازهیدروژن و محلول هیدروکسید را که به شدت قلیایی است به وجود می آورند . \( 2M+H_{2}O\longrightarrow 2MOH+H_{2} \)در اکسیژن هوا به اکسید تبدیل می شوند ، اما در اکسیژن خالص ، لیتیم به \( Li_{2}O \)( همراه با اندکی\( Li_{2}O_{2} \) ) ، سدیم به \( Na_{2}O_{2} \)تبدیل می شود . ( در فشار و دمای بالاتر ، کمی \( Na_{2}O \)نیز تشکیل می شود . )اما عنصرهای دیگر این گروه به سوپراکسید\( MO_{2} \) تبدیل می شوند . \( 4Li+O_{2}\longrightarrow 2Li_{2}O\\ 2Na+O_{2}\longrightarrow Na_{2}O_{2}\\ K+O_{2}\longrightarrow KO_{2} \)
هر سه نوع اکسید این فلزها ، ساختار یونی دارند و در سرما با آب واکنش می دهند . \( M_{2}O+H_{2}O\longrightarrow2M^{+}+2OH^{-}\\ M_{2}O_{2}+2H_{2}O\longrightarrow2M^{+}+2OH^{-}+H_{2}O_{2}\\ 2MO_{2}+2H_{2}O\longrightarrow2M^{+}+2OH^{-}+O_{2}+H_{2}O_{2} \)
- چرا با افزایش عدد اتمی فلزهای قلیایی ، تمایل آنها به تشکیل پراکسید و سوپراکسید بیشتر می شود ؟ دلیل تشکیل پراکسید و سوپراکسید ب عنصرهای پایین تر این گروه ، بزرگتر بودن اتم آنها و تمایل آنها به ترکیب شدن با آنیون های بزرگتر برای به دست آوردن پایداری بیشتر است .
- همۀ فلزهای قلیایی با الکل واکنش می دهند و الکوکسید \( (RO^{-}) \)تشکیل می دهند که در واکنش های هسته دوستی اهمیت دارد . با آمونیاک مایع واکنش می دهند و سدیم آمید\( (NaNH_{2}) \) تولید می کنند . به دلیل حلال پوشی الکترون ، محلول حاصل رنگی می شود ( در مورد سدیم ، محلول حاصل آبی رنگ است . ) با آمین ها نیز ترکیب های مشابهی به وجود می آورند که در واکنش های آلی – اهمیت دارند . \( 2Na+2NH_{3}\longrightarrow 2NaNH_{2}+H_{2} \)باهالوژن ها (X) ، گوگرد ، سلنیم ، تلور، فسفر، آرسنیک و آنتیموان نیز در گرما واکنش می دهند .
\( 2M+X_{2}\longrightarrow2MX\\ 2M+S\longrightarrow M_{2}S\\ 3M+P\longrightarrow M_{3}P \)
کاربردهای مهم : لیتیم برای افزودن استحکام فلزهایی مانند روی ، منیزیم و آلومینیم به آنها افزوده می شود و در تهیه ترکیب های آلی – لیتیم مصرف می شود . سدیم به صورت آلیاژ با سرب ، در تهیه سرب تترا اتیل( ماده ضد کوبش ) برای افزودن به بنزین مورد استفاده قرار می گیرد . آلیاژ سدیم با پتاسیم ( مایع ) در انتقال گرما و خنک کردن رآکتورهای هسته ای مصرف می شود . سدیم ( به صورت پخش شده روی سدیم کربنات ) ، به عنوان کاتالیزگر در بسیاری از واکنش های افزایشی آلکن ها و نیز به عنوان عامل کاهنده قوی در شیمی کاربرد دارد . از پتاسیم نیز به عنوان عامل کاهنده قوی استفاده می شود . سزیم در تهیه سلول فوتوالکترکی به کار می رود . ( به دلیل انرژی یونش بسیار کم آن )
شناسایی فلزهای قلیایی و ترکیب های آنها براساس رنگ شعله : هریک از فلزهای قلیایی و ترکیب های آنها رنگ مشخصی در شعله به وجود می آورند . دلیل این رویداد این است که الکترون لایه خارجی اتم آنها می تواند به آسانی برانگیخته شود و این کار را از راه جذب انرژی کووانتوم های معینی از ناحیه مرئی تابش های الکترومغناطیسی ( نور سفید ) انجام می دهد و سبب ایجاد رنگ های مشخص می شود . خواص این رنگ ها اساس تشخیص و تعیین مقدار آنها در روش نور شعله سنجی و طیف نمایی جذب اتمی است . رنگ شعله و طول موج های جذب شده مربوط به هر یک از فلزهای قلیایی در جدول زیر داده شده است .






برای نوشتن دیدگاه باید وارد بشوید.