قانون هنری ، قانون پخش گازها
قانونی که در ارتباط با تاثیر فشار و حل شدن گازها در مایعات است که در سال 1803 توسط هنری کشف شد .
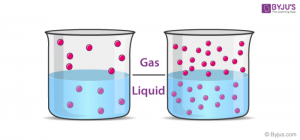
« جرم گازی که در حجم معین از یک مایع ، در دمای معین حل می شود ، با فشارجزئی آن گاز بر روی محلول بستگی مستقیم دارد و این درصورتی است که گاز نسبتا کم محلول و یا محلول رقیق باشد و با حلال برهم کنش شیمیایی نداشته باشد .
مثل بررسی قانون هنری با استفاده از گازهای :
در دمای صفر درجه سلسیوس و فشار معمولی مقدار 0/34 گرم گاز کربن دی اکسید در 100 میلی لیتر آب حل می شود . اما اگر فشار گاز را دو برابر کنیم مقدار بیشتری از آن یعنی تقریبا 0/68 گرم از گا ز در آب حل می شود .
یعنی می توان گفت که قانون هنری ورابطه ۀن به صورت : که در این رابطه
بیانگر فشارگاز و
ثابت هنری و
نشان دهنده غلظت گاز می باشد .
از آن جایی که چگالی گاز نیز متناسب با میزان افزایش فشار بیشتر می شود این 0/68 گرم گاز ، با دو برابر شدن فشار ، همان حجمی را خواهد داشت که 0/34 گرم از گاز در فشار معمولی اشغال می کند . از این رو می توان این استنباط را داشت که حجم گاز حل شده در یک حجم معین از یک مایع در دمای ثابت به فشار آن بستگی ندارد . به همین دلیل است که میزان انحلال پذیری گاز معمولا به جای گرم بر حسب میلی لیتر بیان می شود که نشان دهنده حجم گازی است که در دمای معین در 100 میلی لیتر حلال ( آب ) حل می شود .
مقایسه میزان انحلال پذیری گاز ها در دمای اتاق
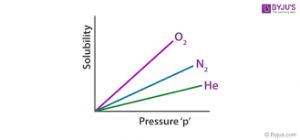
در دمای اتاق ( 20 درجه سلسیوس ) میزان انحلال پذیری گازها
[ninja_tables id=”2305″]
سوال : چرا انحلال پذیری گاز کلر نسبت به سایر گازهای جدول بیشتر است ؟
گا زکلر در آب بیشتر به صورت شیمیایی در آب حل می شود .
سوال : انحلال پذیری ( جدای از قانون هنری ) گاز کربن دی اکسید نسبت به گاز اکسیژن در آب بیشتر است ، چرا ؟
گاز نیتروژن در آب انحلال مولکولی دارد ازطریق ایجاد جاذبه واندروالسی در حالی که گاز کربن دی اکسید بر اساس واکنش زیر ، در آب انحلال یونی – مولکولی دارد .
سوال : چرا ( طبق قانون هنری ) میزان انحلال پذیری گاز اکسیژن ، بیشتر از میزان انحلال پذیری گاز هیدروژن است ؟
هر دو گاز مولکول های ناقطبی دارند و در بین مولکول های آنها نیروی جاذبه واندروالسی بر قرار است ، اما گاز اکسیژن به دلیل دارا بودن جرم مولکولی بیشتر و حجم بیشتر نیروی جاذبه واندروالسی قوی تر با آب خواهد داشت .





برای نوشتن دیدگاه باید وارد بشوید.