فلزات قلیایی خاکی عبارتند از : بریلیم ، منیزیم ، کلسیم ، استرنسیم ، باریم و رادیُم که فلزهایی به نسبت واکنش پذیر هستند .
وجود در طبیعت : بریلیم درطبیعت به صورت بریل\( (Be_{3}Al(SiO_{3})_{6}) \) ، منیزیم به طور عمده به صورت دولومیت \( (CaCO_{3},MgCO_{3}) \)و کارنالیت\( (KMgCl_{3}.6H_{2}O) \) ، در سیلیکات های طبیعی و نمک های محلول در آب دریا وجود دارد . کلسیم به صورت انواع کربنات ها ، سنگ گچ\( (CaSO_{4}.2H_{2}O) \) ، دولومیت و سیلیکات ها یافت می شود . استرنسیم به طور عمده به صورت استرونسیت\( (SrCO_{3}) \) و باریم به صورت باریت \( (BaSO_{4}) \)در طبیعت وجود دارد . رادیُم بسیار کمیاب است (در سنگ معدن اورانیوم به صورت ناخالصی یافت می شود .)
فلزهای قلیایی خاکی ، جلای سفید نقره ای دارند و به نسبت نرم اند . دماهای ذو ب و جوش ، چگالی ، گرماهای ذوب و تبخیر آنها از فلزهای قلیایی همدوره خود بالاتر است . دلیل آن ، بیشتر بودن تعداد الکترون های لایه ظرفیت اتم ، کوچکتر بودن شعاع فلزی آنها و متبلور شدن در سیستم های انباشته تر است . خواص فیزیکی این فلزها در جدول زیر ارائه شده است .
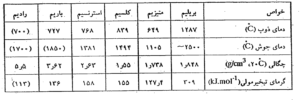 در جدول زیر ، برخی خواص اتمی فلزهای قلیایی خاکی داده شده است .
در جدول زیر ، برخی خواص اتمی فلزهای قلیایی خاکی داده شده است .
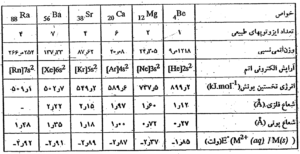 خواص شیمیایی : انرژی های نخستین و دومین یونش فلزهای قلیایی خاکی به نسبت کم ، اما انرزی سومین یونش آنها بسیار بالاست ، از این رو در واکنش های شیمیایی به آسانی دو الکترون لایه ظرفیت اتم خود را از دست می دهند و به کاتیون \( M^{2+} \)با آرایش الکترونی اتم گاز نجیب قبل از خود تبدیل می شوند . ( با عد اکسایش دیگری در ترکیب ها شرکت نمی کنند . )
خواص شیمیایی : انرژی های نخستین و دومین یونش فلزهای قلیایی خاکی به نسبت کم ، اما انرزی سومین یونش آنها بسیار بالاست ، از این رو در واکنش های شیمیایی به آسانی دو الکترون لایه ظرفیت اتم خود را از دست می دهند و به کاتیون \( M^{2+} \)با آرایش الکترونی اتم گاز نجیب قبل از خود تبدیل می شوند . ( با عد اکسایش دیگری در ترکیب ها شرکت نمی کنند . )
اصولاً بعد از فلزهای قلیایی ، فعّال ترین فلزها محسوب می شوند . مانند فلزهای قلیایی ، در طبیعت به حالت آزاد یافت نمی شوند . اگر چه انرژی نخستین و دومین یونش آنها نسبت به انرژی یونش فلزهای قلیایی بیشتر است ، اما در مقابل ، انرژی آبپوشی و انرژی شبکه بلور ترکیب های یونی فلزهای قلیایی بیشتر است ( از این رو در محلول و ضمن تشکیل ترکیب های یونی به آسانی به کاتیون \( M^{2+} \)تبدیل می شوند . )
بریلیم ، خواص به نسبت متفاوتی با عنصرهای دیگر این گروه دارد . زیرا شعاع اتمی آن به نسبت کوچک و پتانسیل یونی کاتیون \( (Be^{2+}) \)بسیار زیاد است . از این رو مانند کاتیون \( (Al^{3+}) \)( تشابه قطری بریلیم با آلومینیم ) سبب قطبش شدید آنیونها می شود و به طور عمده پیوند کووالانسی تشکیل می دهد . ( در صورتی که فلزهای دیگر این گروه به طور عمده پیوندهای یونی تشکیل می دهند . ) برای مثال \( (BeCl_{2}) \)، ترکیبی کووالانسی است و در حالت جامد به صورت پلیمر با ساختار زنجیری ( با عدد کوئوردیناسیون 4 ) در می آید .
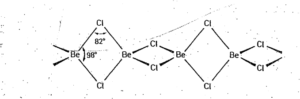 بریلیم سولفید و بریلیم اکسید در حالت گازی ساختار کووالانسی دارند ، اما در حالت جامد شبکه فضایی با عدد کوئوریناسیون 4 به وجود می آورند . ( مانند بلاند روی ) همچنین با مواد آلی قطبی مانند الکل و اتر ترکیب اضافی با فرمول مولکولی\( BeCl_{2}(OEt_{2}) \) تشکیل می دهند . یون آب پوشیده پتانسیل یونی ( چگالی بار مثبت ) زیادی داشته و بر اثر آبکافت ( هیدرولیز )خاصیت اسیدی دارد .
بریلیم سولفید و بریلیم اکسید در حالت گازی ساختار کووالانسی دارند ، اما در حالت جامد شبکه فضایی با عدد کوئوریناسیون 4 به وجود می آورند . ( مانند بلاند روی ) همچنین با مواد آلی قطبی مانند الکل و اتر ترکیب اضافی با فرمول مولکولی\( BeCl_{2}(OEt_{2}) \) تشکیل می دهند . یون آب پوشیده پتانسیل یونی ( چگالی بار مثبت ) زیادی داشته و بر اثر آبکافت ( هیدرولیز )خاصیت اسیدی دارد .
\( [Be(H_{2}O)_{4}]^{2+}+H_{2}O\longrightarrow H_{3}O^{+}+[Be(H_{2}O)_{3}(OH)]^{2+} \)
منیزیم خواصی حدواسط بریلیم و عنصرهای دیگر این گروه دارد . اکسید و هیدروکسید آن مانند بریلیم اکسید و بریلیم هیدروکسید در آب بسیار کم حل می شود . بریلیم و منیزیم بر خلاف عنصرهای دیگر این گروه در دمای معمولی با آب واکنش نمی دهند . امّا با بسیاری از نافلزها در دمای معمولی یا بر اثر گرما واکنش می دهند .
تفاوت عمده فلزهای قلیایی خاکی با فلزهای قلیایی در این است که بسیاری از ترکیب های آنها در آب نامحلول اند . غیر از نیترات ، استات و هالید ( به جز\( CaF_{2} \) )نمک های دیگر آنها در آب حل نمی شوند . انحلال پذیری( حلالیت ) اکسید و هیدروکسید آنها با افزایش عدد اتمی افزایش می یابد . اما انحلال پذیری سولفات و کرومات آنها با افزایش عدد اتمی آنها کم می شود . ( با افزایش عدد اتمی ، انرژی آبپوشی آنها بیش از انرژی شبکه بلور آنها کاهش می یابد . ) برخی از ترکیب های آنها مانند\( MgI_{2} , MgBr_{2} \) و \( CaF_{2} \)که خصلت کووالانسی قابل توجهی دارند و به همین دلیل با تشکیل ترکیب های اضافی مانند \( MX_{2}(OEt)_{2} \)در حلال های آلی قطبی مانند الکل حل می شوند . با افزایش عدد اتمی پایداری کربنات و نیترات آنها در مقابل گرما افزایش می یابد . برای مثال بریلیم کربنات در دمای ولی باریم کربنات در دمای تجزیه می شود .
\( BeCO_{3}\overset{100^\circ C}\longrightarrow BeO+CO_{2}\\ BaCO_{3}\overset{1360^\circ C}\longrightarrow BaO+CO_{2} \)
خواص شیمیایی فلزهای قلیایی خاکی را می توان چنین خلاصه کرد :
- با تمام هالوژن ها در گرما واکنش می دهند . \( M+X_{2}\longrightarrow MX_{2} \)
- با اکسیژن به اکسید یا پراکسید تبدیل می شوند . \( 2M+O_{2}\longrightarrow 2MO \)در دمای بالا : \( Ba+O_{2}\longrightarrow BaO_{2} \)
- با نیتروژن و فسفر در دمای بالا واکنش می دهند . \( 3M+N_{2}\longrightarrow M_{3}N_{2}\\ 6M+P_{4}\longrightarrow2M_3P_{2} \)
- با کربن افزوخته شده ترکیب می شوند . ( دما بالا )\( M+2C\longrightarrow MC_{2} \)
- با گاز هیدروژن در دمای بالا واکنش می دهد . \( M+H_{2}\longrightarrow MH_{2} \)
- کلسیم ، استرنسیم و باریم با آب در دمای معمولی واکنش می دهند اما منیزیم اگرداغ باشد با بخار آب جوش واکنش می دهد .
( در دمای معمولی) \( M+2H_{2}O\longrightarrow H_{2}+M(OH)_{2} \)
( بخار آب جوش ) \( Mg+H_{2}O\longrightarrow H_{2}+MgO \)
( بریلیم حتی در دمای سرخ ( بالاتر از 100 درجه )با آب واکنش نمی دهد . )
- به هیدروکلریک اسید و محلول رقیق سولفوریک اسید و استیک اسید واکنش داده و گاز هیدروژن آزاد می کند .
\( M+2H^{+}\longrightarrow M^{2+}+H_{2} \)
- کلسیم ، استرنسیم و باریم ، مانند فلزهای قلیایی با آمونیاک مایع واکنش می دهند .
\( M+2NH_{3}(l)\longrightarrow M(^{2+}NH_{2})_{2}+H_{2} \)
روش های تهیّه : بریلیم را در صنعت به روش کاهش کلرید یا اکسید آن به وسیله کلسیم یا منیزیم تهیه می کنند .
\( BeCl_{2}(s)+Mg(l)\longrightarrow Be+MgCl_{2} \)
منیزیم را به صورت هیدروکسید از آب دریا جدا می سازند و به صورت کلرید در می آورند ، پس از خشک کردن آن را ذوب و برق کافت ( الکترولیز ) می کنند . منیزیم را از تجزیه گرمایی دولومیت نیز طبق واکنش های زیر تهیه می کنند .
\( CaCO_{3}.MgCO_{3}\longrightarrow 2CO_{2}(g)+CaO.MgO\\ CaO.MgO+FeSi\longrightarrow Mg+FeSiO_{3}+CaSiO_{3} \)
کاربردهای فلزهای قلیایی خاکی : چون بریلیم ، پرتوهای X را از خود عبور می دهد از آن در تهیه دریچه دستگاه های مولّد پرتوهای X استفاده می کنند ، چون دیرگداز و پوشاننده است و خواص سرامیکی دارد ، در ساختار راکتور اتمی مصرف می شود . با نیکل آلیاژی می دهد که در مقابل آب دریا مقاوم است ، از این رو در کشتی سازی مصرف می شود .
کلسیم به عنوان کاهنده در استخراج فلزها ( به ویژه لانتانیدها و اکتنیدها ) مصرف می شود . به دلیل میل ترکیبی زیادی که با اکسیژن و نیتروژن دارد ، برای جذب هوای محلول در فلزهای مذاب و در تخلیه کامل هوای داخل لامپ های الکتریکی از آن استفاده می شود .
منیزیم در تهیه آلیاژهای سبک و بسیار محکم به ویژه با آلومینیم در صنعت هواپیما سازی مصرف می شود ( به صورت واکنشگر گرینیارد در تهیه مواد آلی نیز کاربرد دارد . )





برای نوشتن دیدگاه باید وارد بشوید.