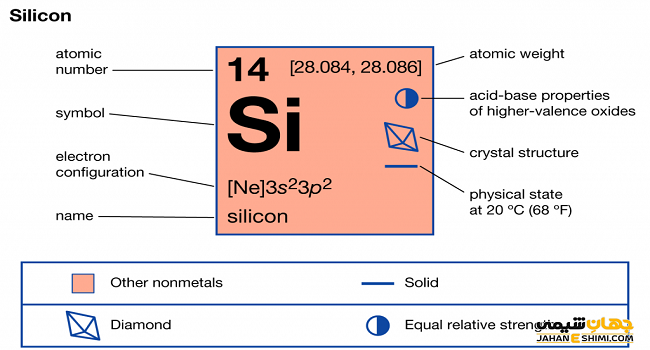
سیلیسیم که با نماد شیمیایی نشان داده می شود از جمله عناصر شبه فلزی موجود در جدول نماوبی است . این عنصر با نام های سیلیکون ، سیلیکا نیز شناخته می شود .جایگاه این عنصر در جدول تناوبی ( دوره ای ) در خانه چهاردهم و گروه چهاردهم است . جامدی بلورین شکننده و سخت است و رنگ آبی متمایل به خاکستری دارد . این عنصر چهار الکترون در لایه ظرفیت خود دارد و از طریق ایجاد پیوند کووالانسی ( اشتراکی ) با هیدروژن و نافلزات ، آرایش الکترونی لایه ظرفیت خود را هشتایی می کنذ . واکنش پذیری آن، از عنصر کربن ( هم گروه ) کمتر ولی از ژرمانیم که شبه فلز پایین تر از خود است ، بیشتر می باشد . این عنصر شعاع اتمی کمتری نسبت به آلومینیم دارد .
نقطه ذوب : 1415 درجه سلسیوس ، نقطه جوش : 3270 درجه سلسیوس
چگالی سیلیسم در حالت مایع بیشتر از حالت جامد آن است . رسانایی گرمایی بالایی دارد و به این دلیل در پوشش دادن اجسام داغ کاربردی ندارد این عنصر با هالوژن ها و فلزات قلیایی واکنش می دهد اما بیشتر اسید ها بر آن اثری ندارد .
واکنش هیدروفلوئوریک اسید بر سیلیسم :
تهیه سیلیسم : می توان از حرارت دادن سیلیس و کک
در دمایی حدود 3000 درجه سلسیوس در کروه الکتریکی به دست آورد .
اگر بخواهیم Si را در صنایع الکترونیک استفاده کنیم ، ابتدا سیلیسیم را با کلر واکنش می دهند و سپس سیلیسیم تترا کلرید را با منیزیم وارد واکنش می کنند .
منیزیم کلرید با استفاده از آب از Si حاصل جدا می کنیم و سپس سیلیسیم را مذاب را به صورت میله هایی به حالت انجماد در می آوریم .برای خالص سازی سیلیسیم با درصد بالاتر جهت مصرف در صنایع الکترونیک از روش ذوب موضعی استفاده می کنیم با این روش که میله های Si را در کوره مخصوص قرار می دهیم و با حرکت دادن تدریجی گرم کن کوره ، منطقه مذاب را در طول لوله پیش می رانیم . از آن جایی که ناخالصی ها در بلور سیلیسیم قرار نمی گیرند به تدریج در ناحیه مذاب وارد شده و در آخر در انتهای میله جمع می شوند و آن را با برش دادن جدا می کنند .
Siهمانند کربن و ژرمانیم به هنگام بلوری شدن ، ساختاری شبیه الماس پیدا می کند . Siدارای سه ایزوتوپ می باشد .
سیلیسیم اکثرا به صورت صنعتی و بدون خالص سازی استفاده می شود و در واقع اغلب با پردازش نسبتا کمی از شکل طبیعی آن استفاده می شود .
واکنش های سیلیسم :سیلیکون با آب ، حتی در حالت بخار در شرایط عادی واکنش نمی دهد ،
واکنش سیلیسیم با هوا : سیلیکون یا سیلیسیم با لایه نازکی از پوشیده شده و در نتیجه به راحتی با اکسیژن ادامه واکنش را نخواهد داشت مگر این که در دمای بالاتر از 900 درجه سلسیوس :
واکنش سیلیسیم با بازها : سیلیسیم با محلول های قلیایی داغ واکنش داده و آنیون سیلیکات تشکیل می دهد .
واکنش سیلیسیم با نیتروژن هوا : با نیتروژن هوا در دماهای بالاتر از 1400 درجه سلسیوس واکنش داده و نیترید های سیلیسیم را می دهد .
واکنش سیلیسیم با هالوزنها ( عناصر نافلزی گروه هفدهم از جدول دوره ای ) :
سوال : ُSi دارای چند ایزوتوپ پایدار می باشد ؟ دارای سه ایزوتوپ پایدار می باشد .




برای نوشتن دیدگاه باید وارد بشوید.