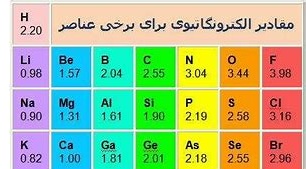
اوّلین بار پاولینگ در سال 1932 مفهوم الکترونگاتیوی عناصر را در شیمی وارد و آن را چنین توصیف کرد : « الکترونگاتیوی هرعنصر ، عبارت است از میزان تمایل اتم آن به جذب جفت الکترون های پیوندی به سمت خود در یک مولکول است . »قابل توجّه است که الکترونگاتیوی را معمولاً با علامت X نشان می دهند .
محاسبه الکترونگاتیوی عناصر به روش پاولینگ : با اندازه گیری انرژی پیوند کووالانسی بین اتم ها به روش ترمودینامیکی و بررسی نتایج حاصل ، معلوم شده بود که مقدار تجربی انرژی پیوند کووالانسی بین دو اتم A و B (\( E_{A-B} \))همواره از مقدار میانگین ( حسابی یا هندسی ) انرژی های پیوند بین دو اتمA (\( E_{A-َA} \)) و دو اتم B (\( E_{B-B} \))بیشتر است . یعنی می توان نوشت : \( E_{A-B}>\frac{1}{2}[E_{A-A}+E_{B-B}] \) و یا :\( E_{A-B}>[E_{A-A}.E_{B-B}]^\frac{1}{2} \)
پاولینگ این تفاوت انرژی یعنی \( \Delta E_{(A-B)} \)را به تفاوت بین الکترونگاتیوی دو اتم A و B یعنی \( \Delta X_{A-B} \)نسبت داده بود . زیرا وی دریافته بود که هر چه تفاوت الکترونگاتیوی دو عنصر بیشتر باشد ، میزان جا به جایی الکترون های پیوندی به سمت اتم الکترونگاتیوتر بیشتر بوده ، مقدار بارهای الکتریکی جزئی \( (\delta \pm ) \)بر روی دو اتم ظاهر می شود ، افزایش می یابد . در نتیجه بین دو اتم علاوه بر پیوند کووالانسی ، نیروی جاذبه الکتروستاتیکی ( خصلت یونی ) نیز به وجود می آید که موجب محکم تر شدن پیوند بین دو اتم و زیادتر شدن انرژی پیوند بین دو اتم خواهد شد .
وی با بررسی های دقیقی که انجام داد ، معلوم داشت که ریشه دوم با تفاوت بین الکترونگاتیوی دو اتم AوB تناسب مستقیم دارد ، یعنی : \( \Delta X(AB)\alpha \Delta E(A-B)^{\frac{1}{2}} \) و یا \( \Delta X(AB)=K\Delta E(A-B)^{\frac{1}{2}} \)چنانچه مقادیر انرژی های پیوندی بر حسب کیلوکالری برمول بیان شده و \( \Delta E_{A-B} \)میانگین حسابی انرژی پیوند های A-A و B-B باشد ، مقدار ثابت K برابر 0.208 است . و اگر \( \Delta E_{A-B} \)میانگین هندسی بین انرژی ها باشد ، مقدار ثابت K برابر 0.182 است . هرگاه مقادیر انرژی های پیوندی برحسب الکترون ولت بیان شود ( هر الکترون ولت برابر 23.06 کیلوکالری برمول است . ) مقدار ثابت K برابر واحد است .
قابل توجّه است که در این روش می توان تفاوت بین الکترونگاتیوی دو اتم را حساب کرد و محاسبه آن برای هیچ یک از دو اتم امکان پذیر نیست . از این رو پاولینگ برای تعیین الکترونگاتیوی اتمها ، دریافته بود که باید یکی از عناصر را به عنوان مبنا و الکترونگاتیوی آن را به طور قراردادی برابر مقدار معینی در نظر بگیرد .
به این منظور هیدروژن را به عنوان مبنا و الکترونگاتیوی آن را به طور دلخواه برابر 2.2 در نظر گرفت و با استفاده از مقادیر انرژی های پیوندی و رابطۀ : \( \Delta X_{A-B}=X_{A}-X_{B} \)مقدار الکترونگاتیوی اتم هایی را که با هیدروژن پیوند کووالانس یتشکیل می دهند حساب کرده و با استفاده از مقادیر به دست آمده توانست الکترونگاتیوی بسیاری از اتم های دیگر را نیز به دست آورد . این مقادیر با بسیاری از نتایج تجربی سازگاری داشت و بر اساس آن بسیاری از پدیده ها قابل توجیه بود . از این رو ، مورد پذیرش همگان قرار گرفت . حتی با این که بعد ها چندین روش برای تعیین الکترونگاتیوی عناصر ارائه شده بود ، مقیاس پاولینگ برای الکترونگاتیوی به عنوان یک مقیاس پایه برای الکترونگاتیوی تلقّی و مقادیر به دست آمده از روش های دیگر با این مقیاس پایه ، مقایسه و معمولاً به آن تبدیل می شوند .
مثال: اگر انرژی های پیوند های I-I و H-H و H-I به ترتیب برابر 36 ، 104 و 72 کیلوکالری برمول در نظر گرفته شود ، الکترونگاتیوی یُد را به روش پاولینگ حساب کنید .
\( \Delta E_(H-I)=E_(H-I)+\frac{E_(H-H)+E_(I-I)}{2}=72-\frac{104+36}{2}=72-70=2Kcal/mol\\ \Delta X_(HI)=0.208\sqrt{\Delta E_(H-I)}=0.208\sqrt{2}=0.294 \)
\( \Delta X_{HI}=X_{I}-X_{H} \Rightarrow 0.30=X_{I}-2.2 , X_{I}=2.5 \) از انجایی که مفهوم الکترونگاتیوی اتم ، مفهومی نسبی است و آن را به طور دقیق نمی توان توصیف و مشخص کرد ، از این رو در منابع مختلف در زمینه الکترونگاتیوی با برداشت های متفاوتی از این مفهوم و نیز روش های گوناگون برای تعیین مقدار و مقیاس های مختلفی برای آن برخورد می کنیم . البته نتایج حاصل از این روش های متفاوت با یکدیگر سازگاری داشته و همه باید با به کار بردن ضرایب کعینی به سادگی قابل تبدیل به مقیاس پاولینگ باشند و با آن هماهنگی داشته باشند .
روش مولیکن برای محاسبه الکترونگاتیوی : بر اساس نظر مولیکن ، الکترونگاتیوی هر عنصر ، برابر میانگین حسابی انرژی اولین یونیزاسیون \( (E_{I}) \)و انرژی اولین الکترونخواهی آن \( (E_{EA}) \)بر حسب الکترون ولت است . که با این رابطه می توان این وابستگی را نشان داد : \( X_{M}=\frac{1}{2}(E_{A}+E_{I}) \) که در این رابطه \( X_{M} \)الکترونخواهی مولیکن نامیده می شود . مقدار \( E_{A} \)برای عناصری که نیم واکنش الکترونخواهی آنها گرماده است ، در این رابطه مثبت در نظر گرفته می شود .
برای تبدیل الکترونگاتیوی مولیکن به مقیاس پاولینگ می توان از رابطه :\( X_{P}=0.34X_{M}-0.20 \) استفاده کرد . این را هم باید در نظر داشته باشیم که برخی از منابع از رابطه های زیر نیز استفاده کرده اند . \( X_{P}=0.336(X_{M}-0.615) , X_{P}=0.168(E_{EA}+E_{I}-1.23) \)
مثال : اگر انرژی های اولین یونش و الکترونخواهی اتم هیدروژن به ترتیب برابر 313.3 و 17.3 کیلوکالری برمول در نظر گرفته شود ، الکترونگاتیوی اتم هیدروژن را به روش مولیکن حساب کرده و آن را به مقیاس پاولینگ تبدیل کنید .با توجّه به این که هر الکترون ولت برابر 23.06 کیلوکالری برمول است .
\( E_{I}=\frac{313.3}{23.06}=13.59ev\\ E_{EA}=\frac{17.3}{23.06}=0.540ev\\ X_{M}=\frac{1}{2}(13.6+0.5)=7.1ev\\ X_{P}=(0.34\times 7.1)-0.2=2.1 \)
روش آلرد روکو برای محاسبه الکترونگاتیوی : الکترونگاتیوی را خاصیتی در ارتباط با نیروی جاذبه هستۀ اتم بر الکترون های لایه ظرفیت توصیف کرده و این رابطه پیشنهاد کرد .\( X(A.R)=\frac{Z^{*}e^{2}}{r^{2}} \)که \( Z^{*} \)بارموثر هسته ، e برابر\( 4.8\times 10^{-10} \) واحد الکتروستاتیکی و r شعاع کووالانسی اتم بر حسب سانتی متر است . باید بدانیم که مقادیر به دست آمده با این روش ، دقیق تر از روش های پیشین بوده و با خواص دیگر اتم سازگاری بیشتری دارد . به علاوه بر اساس این رابطه ارتباط بین شعاع اتم با الکترونگاتیوی و بارموثّر هسته آن و چگونگی این ارتباط روشن شده و با استفاده از آن بهتر و ساده تر از روش های پاولینگ و مولیکن می توان روندهای تغییرات الکترونگاتیوی عناصر را در دوره ها و گروه های جدول تناوبی توجیه کرد .
برای تبدیل و تطبیق الکترونگاتیوی آلرد- روکو به مقیاس پاولینگ می توان از این رابطه استفاده کرد . \( X(P)=0.359\frac{Z^{*}}{r^{2}}+0.744 \)در این رابطه ، r شعاع کووالانسی برحسب آنگستروم است .
مثال: بار موثر هسته را برای الکترون لایه ظرفیت اتم اکسیژن به روش اسلیتر حساب کرده ، با استفاده از آن مقدار الکترونگاتیوی اکسیژن را به روش آلرد – روکو به دست آورید و آن را به مقیاس پاولینگ تبدیل کنید . ( شعاع کووالانسی اتم اکسیژن برابر 0.74 آنگستروم است . )
\( O=1S^{2}2S^{2}2P^{4}\\ \sigma=(5\times0.35)+(2\times0.85)=3.45\\ Z^{*}=Z-\sigma=8-3.45=4.55 \\X_{A.R}=\frac{4.55(4.8\times10^{-10}esu)^{2}}{(0.74\times10^{-8}cm)^{2}}=0.019(esu)^{2}/cm^{2}\\ X_{P}=0.359\times\frac{4.55}{(0.74)^{2}}+0.744=3.7 \)
تغییرات الکترونگاتیوی : با توجه به این که مقدار انرژی هر پیوند ، مقدار انرژی یونیزاسیون ، مقدار انرژی الکنرونخواهی ، بار موثر هستهو شعاع کووالانسی اتم مقدار ثابتی است ، چنین به نظر می آید که الکترونگاتیوی هر اتم خاصیتی تغییر ناپذیر و مقدار آن همواره ثابت است . ولی این تصوری بیش نیست زیرا بررسی ها نشان داده است که الکترونگاتیوی اتم خصاتی تغییر پذیر است و چگونگی و میزان این تغییر به وضعیت اوربیتال های اتم ، یعنی به نوع هیبریداسیون اوربیتال های آن و نیز به تعداد و نوع اتم ها یا گروه های اتمی که در ترکیبات با آن پیوند دارند (یعنی در حقیقت به مقدار بار الکتریکی جزئی آن در ترکیب مورد نظر )بستگی دارد .



برای نوشتن دیدگاه باید وارد بشوید.