بوهر در سال 1913 برای برطرف کردن نواقص و نارسائی نظریه اتمی رادرفورد ، نظریه جدیدی در باره ساختار اتم هیدروژن و یون های هیدروژن مانند ( یعنی گونه های تک الکترونی مثل \( \large _{3}Li^{2+}, _{2}He^{+} \))ارائه داد که بیشتر از هر نظریه در زمینه های شیمی یا فیزیک مورد پذیرش جهانی قرار گرفت .بوهر نظریه اتمی خود را با توجّه به نکات زیر یعنی : قبول نظریه رادرفورد ( یعنی مسیرهای دایره ای برای جرکت الکترون به دور هسته )، استفاده از نظریه کووانتومی تابش های الکترومغناطیسی ، استفاده از نتایج تجربی حاصل از بررسی های طیف شناسان ، به ویژه خطّی بودن طیف نشری اتم هیدروژن به صورت دو پذیره بیان داشت
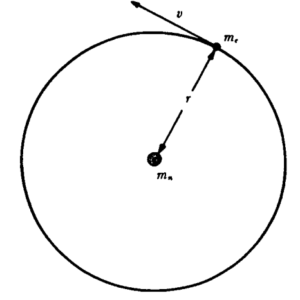
پذیره اوّل : اتم هیدروژن ، دارای هسته ای با بار( Z=+e ) و یک الکترون با بار (e – ) است . و این الکنرون بر خلاف نظر رادرفورد در مسیرهای دایره ای به هم پیوسته ، به دور هسته نمی چرخد ، بلکه بر اساس نظریه کووانتومی ، بر روی مسیرهای دایره ای مجزّایی که به فاصله معینی از هسته قرار داشته و نموداری از سطح انرژی مشخص و ثابتی است ، که مطابق شکل زیر به دور هسته می چرخد . تا هنگامی که الکترون بر روی چنین مدار مجاز و پایداری می چرخد به هیچ صورت انرژی خود را از دست نمی دهد و تابشی منتشر نمی کند به عبارت دیگر سرعت و انرژی آن همواره بر روی چنین مداری ثابت باقی می ماند ، از این رو این مدار ها را « مدار های ایستاده » می نامند .
امروزه به جای مدار ، تراز انرژی و یا حالت انرژی به کار می برند . با توجه به نظریه کووانتومی ، قاصله ترازهای مجاز از هسته اتم ، طوری باید تنظیم شود که اندازه حرکت زاویه ای الکترون بر روی هریک از آنها مضرب درستی از واحد بنیادی کووانتوم ( یعنی \( \large \frac{h}{2\Pi} \)) باشد . یعنی همواره باید داشته باشیم، \( \large \overrightarrow{l}=mvr=n\frac{h}{2\pi} \)که در آن ، اندازه حرکت زاویه ای الکترون ، m ، v و r به ترتیب سرعت حرکت الکترون ، جرم و شعاع مدار مجاز است . n عدد درستی برابر 1 ، 2 ، 3 ، 4 و ….. می باشد که عدد کووانتومی نامیده می شود . ( امروزه به عدد کووانتومی اصلی موسوم است . ) نیروی جاذبه الکتروستاتیکی بین هسته و الکترون بر روی هر مدار ایستاده به وسیله نیروی مرکز گرای حاصل از چرخش الکترون به دور هسته بر روی آن مدار ( مطابق شکل بالا ) جبران می شود . به طوری که شعاع آن مدار همواره ثابت باقی مانده ، از نزدیک شدن تدریجی الکترون به هسته اتم و یا افتادن آن بر روی هسته جلوگیری می شود . بر اساس این پذیره ، بوهر نه تنها ایراد نظریه رادرفورد را برطرف کرد ، بلکه امکان توجیه مسائلی نظیر شعاع مدارها ، شکل آنها و شعاع و یا حجم اتم و ….. ر ا برطرف کرد .
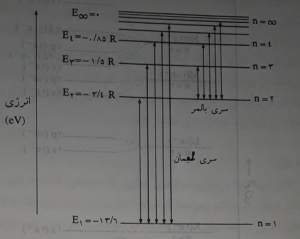
پذیره دوم : بر اساس نظریه کووانتومی تابش های الکترومغناطیسی ، اتم فقط موقعی می تواند تابش کند که یک کووانتوم مشخص از انرژی را جذب کرده و الکترون را از سطح انرژی مجاز \( \large E_{1} \)به سطح انرژی مجاز معین بالاتر \( \large E_{2} \)ارتقا دهد . چنین الکترونی در بازکشت از سطح انرژی بالاتر به سطح انرژی پایین تر ، تفاوت انرژی این دو حالت را به صورت یک کووانتوم انرژی ( که برابر همان کووانتوم انرژی جذب شده به وسیله اتم است ) تابش می کند . یعنی می توان نوشت : \( \large\Delta E=E_{2}-E_{1}=h\nu \)
به این ترتیب بوهر توانست زیر بنایی نظری در مورد چگونگی جذب و تابش انرژی به وسیله اتم و توجیه طیف اتم هیدروژن ارائه دهد .
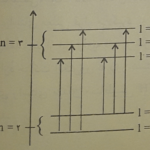
ترتیب قرار گرفتن تراز های مجاز انرژی الکترون به دور هسته اتم 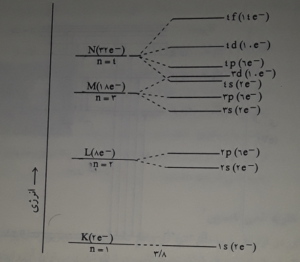
مطابق شکل زیر ، الکترون در اتم هیدروژن برانگیخته شده در طیف نما ، هنگامی که به تراز بالاتر می روذ ، در برگشت ممکن است به تراز اوّل ، دوّم ، سوم ، چهارم و غیره سقوط کند ، چون هر سقوط بین دو تراز انرژی با تابش یک کوانتوم انرژی که با خط طیفی مشخص می شود همراه است ، وجود خط های طیفی زیاد در طیف نشری اتم هیدروژن روشن می شود . از طرفی چون سقوط الکترون ها از ترازهای بالاتر به هر تراز معین پایین تر ، یک سری خط های طیفی نزدیک به هم را به وجود می آورد ، توانست وجود سری های متفاوت خط های طیفی در اتم هیدروژن را نیز روشن سازد . علاوه بر آن بوهر توانست شعاع مدارهای مجاز ( تراز های اصلی انرژی ) ، سرعن الکترون بر روی هر تراز و انرژی الکترون در آنها را حساب کند . مطلبی که جلب توجه می کند این است که بوهر بر اساس نظریه خود ، ,نتوانسته بود علت این که یک خط طیفی در طیف نمای قوی به صورت چند خط نزدیک به هم در می آید ( چند گانگی خطوط طیفی ) را توجیه کند . زیرا بوهر با فرض مسیر دایره ای شکل چرخش الکترون به دور هسته ، تنها یک درجه آزادی ( زاویه دوران ) برای جرخش الکترون به دور هسته در نظر گرفت . یعنی تنها عدد کووانتومی اصلی n را در تعیین انرژی الکترون دخالت داد که برای تعیین مقدار دقیق انرژی الکترون کافی نبود .




برای نوشتن دیدگاه باید وارد بشوید.