الکترونخواهی اتم ، یکی از خواص بنیادی آن در حالت آزاد ( حالت گازی ) است که می توان آن را چنین تعریف کرد « الکترونخواهی اتم ، یک نیم واکنش کاهش است که ضمن آن اتم گازی و خنثی در حالت پایه ، الکترون جذب کرده و به یون منفی گازی در حالت پایه مطابق واکنش : \( X(g)+e^{-}\longrightarrow X^{-}(g) \)تبدیل می شود .
بدیهی است که این نیم واکنش به اولین الکترونخواهی اتم مربوط است . می دانیم که اتم ها غالباً در لایه ظرفیت خود اوربیتال خالی و یا نیم پر دارند .از این رو دست کم می توانند یک الکترون اضافی را در این لایه جای دهند . البته در مورد برخی از عناصر ، اضافه شدن دو یا چند الکترون اضافی به لایه ظرفیت امکان پذیر است و در مورد آنها باید الکترونخواهی های متوالی را نیز باید در نظر گرفت .
قابل توجّه است که برخلاف یونش اتمها که همواره با جذب مقدارمعینی انرژی صورت می گیرد ، نیم واکنش اولین الکترونخواهی در مورد برخی از عناصر با آزادشدن و در مورد برخی دیگر با جذب شدن مقدار معینی از انرژی همراه است . ولی در نیم واکنش دومین و یا سومین الکترونخواهی اتم ها ( حتّی اتم هایی که نیم واکنش اولین الکترونخواهی آنهاگرماده است ) با جذب مقادیر معینی از انرژی همراه است .
انرژی الکترونخواهی :انرژی الکترونخواهی ، مقدار انرژی است که ضمن تبدیل اتم گازی خنثی در حالت پایه یه یون منفی گازی در همان حالت براثر جذب الکترون تبادل می شود . به بیانی دیگر ، از لحاظ قدر مطلق برابر \( \Delta H \)نیم واکنش کاهش اتم گازی و تبدیل آن به یون منفی گازی در حالت پایه است . انرژی الکترونخواهی برحسب واحد الکترون ولت ، کیلوژول بر مول و یا کیلوکالری برمول بیان می شود . ( هر الکترون ولت معادل \( 1.6021\times10^{-12} \)ارگ ، 96.48 کیلوژول برمول و یا 23.06 کیلوکالری برمول است . ) و با نشانه های A ، \( E_{A} \) و \( \Delta H_{EA} \)یا نشان داده می شود . در مورد علامت انرژی الکترونخواهی اتم ها باید توجه داشت که معمولاً آن را از نظر قدر مطلق برابر نیم واکنش کاهش اتم ها برطبق معادله : \( X(g)+e^{-}\longrightarrow X^{-}(g) \)در نظر می گیرند .
یعنی در مورد عناصری که نیم واکنش کاهش آنها گرماده است\( (\Delta H_{EA}<0) \) است)، انرژی الکترونخواهی را مثبت و در غیر این صورت مقدار آن را منفی در نظر می گیرند . بر این اساس هر چه انرژی الکترونخواهی عنصری بیشتر باشد ، اتم آن تمایل بیشتری به جذب الکترون در حالت گازی و تبدیل شدن به یون منفی را دارد . بدیهی است که در بحث های کمّی تر ترمودینامیکی به جای انرژی الکترونخواهی باید\( \Delta H \) الکترونخواهی \( \Delta H_{EA} \)را به کاربرد .
محاسبه \( \Delta H \)الکترونخواهی :اندازه گیری\( \Delta H \) الکترونخواهی عناصر به طور مستقیم جز در موارد نادر ، غیر عملی است . از این رو باید آن را در یک روش ترمودینامیکی به طور غیر مستقیم به دست آورد . در این رو از چرخۀ « بورن- هابر» که بر قانون هس مبتنی است ، استفاده می شود . برای مثال ، چرخه بورن – هابر برای تشکیل یک مول\( MX(s) \) به قرار زیر است .
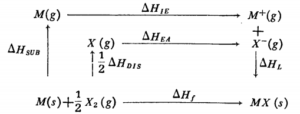
مثال: الکترونخواهی کلر را به روش چرخۀ بورن- هابر حساب کنید . ابتدا چرخۀ بورن – هابر را برای کلرید یک فلز مثلاً سدیم کلریدمی نویسیم
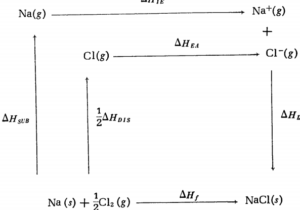
بر اساس قانون هس ، بین \( \Delta H_{f} \)و مقادیر \( \Delta H \)های مراحل جداگانه فرایند تشکیل بلور سدیم کلرید رابطۀ زیر ( رابطه هابر )برقرار است .
\( \Delta H_{f}=\Delta H_{sub}+\Delta H_{IE}+\frac{1}{2}\Delta H_{Dis}+\Delta H_{EA}+\Delta H_{L} \)
چون می توان از طریق ترمودینامیکی مقادیر های دیگر را اندازه گیری کرد ، بر اساس این رابطه می توان مقدار \( \Delta H \)الکترونخواهی کلر را حساب کرد . مقادیر\( \Delta H \)ها در فرایند تشکیل سدیم کلرید (برحسب کیلوکالری برمول ) عبارتند از :
98.2- = ( \( \Delta H \)تشکیل بلورسدیم کلرید از کلرگازی و سدیم جامد )\( \Delta H_{f} \)
25.9+ = ( \( \Delta H \)تبدیل سدیم جامد به سدیم گازی ) \( \Delta H_{sub} \)
118.3+=(\( \Delta H \)یونیزاسیون اتم گازی سدیم ) \( \Delta H_{IE} \)
57.8 + ( \( \Delta H \)تفکیک مولکول کلر به اتم گازی کلر )\( \Delta H_{Dis} \)
؟= (\( \Delta H \) الکترونخواهی کلر که می خواهیم آن را حساب کنیم )\( \Delta H_{EA} \)
184- = ( \( \Delta H \)تشکیل بلور سدیم کلرید از یون های گازی\( Cl^{-} \)و\( Na^{+} \) )
اگر مقادیر این \( \Delta H \)ها را در رابطه قرار دهیم ، مقدار الکترونخواهی کلر برابر 87.3- کیلوکالری برمول خواهد شد .
\( -98.2=(+25.9)+(+118.3)+(-184)+(\frac{+57.8}{2})+\Delta H_{EA} \)
قابل توجّه است که در مورد نافلزاتی که به صورت آنیون \( X^{2-} \)در ساختار بلور شرکت می کنند ، مجموع \( \Delta H \)های اولین و دومین الکترونخواهی آنها با این روش قابل محاسبه است . در این صورت ، چنانچه مقدار\( \Delta H \)اولین الکترونخواهی معلوم باشد ، می توان مقدار \( \Delta H \)دومین الکترونخواهی را حساب کرد . همچنین ، اگر به صورت کاتیون\( M^{2+} \) یا \( M^{3+} \)در ساختار بلور شرکت داشته باشد ، باید مجموع مقادیر\( \Delta H \) های اولین ، دومین و سومین یونیزاسیون آن را به جای \( \Delta H_{IE} \)در رابطه هابر قرار داد .
توجیه روندهای تغییرات انرژی الکترونخواهی اتم ها : در گروه فلزات قلیایی و گازهای بی اثر ، الکترونخواهی عنصر دورۀ دوم از الکترونخواهی دورۀ سوم بیشتر است . دلیل را می توان در مورد فلزات قلیایی این طور توجیه کرد که اولین عنصر گروه قلیایینسبت به اولین عنصر گروه های دیگر شعاع بزرگتری دارد و تفاوت بارموثر هسته اولین عنصر گروه قلیایی ( لیتیُم ) نسبت به بارموثر هستۀ دومین عنصر این گروه در مقایسه با این تفاوت در مورد گروه های دیگر کمتر است . در مورد گازهای بی اثر با توجه به این که نتایج حاصل جنبۀ تجربی ندارد ، اظهار نظری نمی شود .
در مورد عناصر اصلی گروه های دیگر ، الکترونخواهی عنصر دورۀ دوم از الکترونخواهی عنصر دورۀ سوم کمتر (\( \Delta H_{EA} \)بزرگتر ) است . دلیل چنین رویدادی را این طور می توان توجیه کرد که در هر گروه ، اتم عنصر دورۀ دوم از اتم عنصر دورۀ سوّم کوچکتر و بارموثر هسته آن نیز کمتر است . از این رو به هنگام اضافه شدن یک الکترون به لایه ظرفیت ، دافعۀ الکتروستاتیکی بارهای منفی درون اتم عناصر دورۀ دوم افزایش بیشتری حاصل می کند ، در نتیجه سطح انرژی بالاتر رفته و مقدار \( \Delta H \)واکنش الکترونخواهی آن عدد بزرگتری می شود .
منفی بودن \( \Delta H \)الکترونخواهی فلزات قلیایی را می توان به وجود تراز الکترونی نیم پر \( (nS^{1}) \)در لایه ظرفیت اتم نسبت داد . زیرا ، الکترون اضافه شده در این تراز نیم پر قرار گرفته و تاثیر زیادی بر بالارفتن سطح انرژی یون منفی حاصل نمی گذارد .
\( _{11}Na^{0}(1S^{2}2S^{2}2P^{6}3S^{1})+e^{-}\longrightarrow _{11}Na^{-}(1S^{2}2S^{2}2P^{6}3S^{2}) \)
مثبت بودن\( \Delta H \) الکترونخواهی فلزات قلیایی خاکی را می توان به وجود تراز پرشده \( (nS^{2}) \)لایه ظرفیت و آرایش الکترونی نسبتاً پایدارتر اتم آنها نسبت داد ، زیرا الکترون اضافه شده در ترازnP لایه ظرفیت که سطح انرژی بالایی دارد ، وارد می شود که این خود علاوه بر بالارفتن سطح انرژی در یون حاصل ، موجب از بین رفتن تقارن آرایش الکترونی و کاهش پایداری می شود . به طوری که \( \Delta H \)واکنش الکترونخواهی اتم مقداری مثبت خواهد شد .
\( _{12}Mg^{0}(1S^{2}2S^{2}2P^{6}3S^{2})+e^{-}\longrightarrow _{12}Mg^{-}(1S^{2}2S^{2}2P^{6}3S^{2}3P^{1}) \hspace{1cm}\Delta H>0 \)
دلیل مثبت بودن مقدار\( \Delta H \) الکترونخواهی برای اتم نیتروژن و منفی بودن مقدار آن برای اتم فسفر را ( که در یک گروه قراردارند ) این طور می توان توجیه کرد که از یک طرف ، کوچک بودن اتم نیتروژن موجب می شود تا بر اثر اضافه شدن یک الکترون به آرایش الکترونی آن ، مقدار نیرو یدافعۀ الکتروستاتیکی درون اتم به شدت افزایش یابد . ا زطرفی دیگر وجود آرایش الکترونی کاملاً متقارن و وضعیت پایدار آن ( یعنی وجود ترازهای پر و نیم پر در لایه ظرفیت ) اتم نیتروژن که با اضافه شدن یک الکترون از بین خواهد رفت ، عامل مهم دیگری است که شرایط نامناسبی را برای اضافه شدن الکترون به اتم نیتروژن به وجود می آورد . از این رو الکترونخواهی اتم نیتروژن ، نیم واکنشی گرماگیر و\( \Delta H \) آن مقدار مثبت خواهد بود .
اما در مورد اتم فسفر ، اگر چه مانند اتم نیتروژن لایۀ ظرفیت دارای آرایشی کاملاً متقارن است و اضافه شدن یک الکترون به اتم خنثی که چنین آرایش پایداری را از بین خواهد برد ، اصولاًنباید واکنشی گرماده باشد ، ولی برخلاف نیتروژن ، اتم فسفر نسبتاًحجیم است ( شعاع اتمی نیتروژن برابر0.7 در صورتی که شعاع اتمی فسفر برابر1.1 آنگستروم است . ) و اضافه شدن یک الکترون به آرایش الکترونی آن ، دافعۀ الکتروستاتیکی قابل توجهی در آن ایجاد نمی کند . به طوری که مجموع تاثیرات این دو عامل ( آرایش الکترونی متقارن وکم حجم اتم ) در مورد اتم فسفر ، شرایط مناسبی را برای جذب الکترون توسط اتم فراهم می کند. از این رو الکترونخواهی اتم فسفر ، نیم واکنشی گرماده و\( \Delta H \) آن مقداری منفی خواهد بود .
مثبت بودن مقدار \( \Delta H \)الکترونخواهی دوم ، در مورد اتم های اکسیژن و گوگرد را می توان به دو عامل مربوط دانست . 1) وجود نیروی دافعه الکتروستاتیکی بین الکترون ( که بار منفی دارد ) و یون منفی \( O^{-} \)یا \( S^{-} \)که در مرحله اول الکترونخواهی تشکیل می شود و ا زنزدیک شدن الکترون بعدی به این یون های منفی جلوگیری می کند . 2 ) افزایش میزان نیروی دافعۀ الکتروستاتیکی در یون های \( O^{2-} \)و \( S^{2-} \)که در مرحلۀ دوم الکترونخواهی تشکیل می شوند و موجب بالارفتن سطح انرژی این یون ها و در نتیجه ناپایداری آنها ( البته در حالت گازی ) می شود .
بدیهی است که مثبت بودن مقدار \( \Delta H \)الکترونخواهی هلیم ( و به طور کلی گازهای بی اثر ) ، به وجود ترازهای پرلایه ظرفیت و آرایش الکترونی بسیار پایدار اتم آنها مربوط است که برای ورود الکترون اضافی ، شرایط نامساعدی محسوب می شود .
قابل توجه است که بر خلاف شعاع اتمی ، انرژی یونیزاسیون و الکترونگاتیوی اتم که در مورد عناصر اصلی هر دوره با افزایش عدد اتمی به طور کلی افزایش می یابد ، الکترونخواهی اتم از چنین روندی پیروی نمی کند .
دلیل این که الکترونخواهی عناصر دوره سوم به بعد ، با افزایش عدد اتمی به طور کلی در هر گروه کاهش می یابد این است که اگر چه با افزایش عدد اتمی مقدار بارموثر هسته نیز افزایش می یابد ، ولی افزایش شعاع اتم جاذبه هسته را بر لایه ظرفیت اتم به حدّی کاهش می دهد که تمایل آن به جذب الکترون از عنصری به عنصر بعدی در هر گروه کمتر می شود .



برای نوشتن دیدگاه باید وارد بشوید.